Standardisierte Rezepturen nach DAC/NRF
Zur Zubereitung von Cannabinoidarzneimitteln sind standardisierte Rezepturen nach dem Neuen Rezeptur-Formularium (NRF) vorhanden.
Inhalation
- Cannabisblüten zur Inhalation nach Verdampfung (NRF 22.12.)
- Cannabisblüten in Einzeldosen zur Inhalation nach Verdampfung (NRF 22.13.)
- Ethanolische Dronabinol-Lösung 10 mg/ml zur Inhalation (NRF 22.16.)
Orale Einnahme
- Cannabisblüten zur Teezubereitung (NRF 22.14.)
- Cannabisblüten in Einzeldosen zur Teezubereitung (NRF 22.15.)
- Dronabinol-Kapseln 2,5 mg / 5 mg / 10 mg (NRF 22.7.)
- Ölige Dronabinol-Tropfen 25 mg/ml (NRF 22.8.)
- Ölige Cannabidiol-Lösung 50 mg/ml – 400mg/ml (NRF 22.10.)
- Cannabidiol-Kapseln 10 – 250 mg (NRF 22.17.)
Alternative, nicht standardisierte Rezepturen
Neben den in der DAC/NRF standardisierten Rezepturen, ist es möglich, weitere nicht standardisierte Zubereitungen nach §7 Apothekenbetriebsordnung herzustellen. Dieser Paragraph regelt die Herstellung von Rezepturarzneimitteln und legt fest, dass diese der ärztlichen Verschreibung entsprechen müssen.
- Wichtig ist in diesem Zusammenhang die Dokumentation der Plausibilitätsprüfung, der Herstellanweisung und des Herstellprotokolls.
- Bei der Herstellung THC-haltiger Rezepturen ist eine produktionstechnisch bedingte Abweichung von bis zu 10 % zwischen der abgegebenen und der tatsächlich verwendeten Menge nachvollziehbar.
- Vor Produktionsbeginn ist eine individuelle Prüfung der Substanz erforderlich.
Rezeptur Cannabisextrakt-haltiger Hartkapseln
Die Verkapselung von Cannabisextrakten kann die Compliance erhöhen, da Dosierung und Einnahme vereinfacht werden.
- Besonders für Patienten mit motorischen oder visuellen Einschränkungen (z. B. geriatrischen Patienten) geeignet.
- Geeignet für Patienten mit Sensibilität gegenüber Geruch und/oder Geschmack von Cannabisextrakten.
Rezeptur Zusammenfassung
Orientiert an: NRF 22.7, 22.17 sowie Stammzubereitung S.44
Substanz | Funktion | Prüfvorschrift |
|---|---|---|
420 Cannabisextrakt
| Wirkstoff | DAB Monographie „Eingestellter Cannabisextrakt – Cannabis extractum normatum“ |
Polyoxyethyliertes Rizinusöl z.B. Kolliphor® EL | Hilfsstoff: Lösungsvermittler und Emulgator | Ph. Eur., Macrogolglycerol ricinoleate |
Palmityolascorbinsäure | Hilfsstoff: Antioxidans | Ph. Eur., Palmitoylascorbinsäure (Alternative Identifizierung nach DAC/NRF) |
mittelkettige Triglyceride (MCTs) z.B. Softisan® 378 | Hilfsstoff: Lipophiler Trägerstoff | - |
Hartgelatine-Kapselhüllen der Größe 1 | Hilfsstoff | Ph. Eur., Hartfett (Alternative Identifizierung nach DAC/NRF) |
Rezeptbeispiel
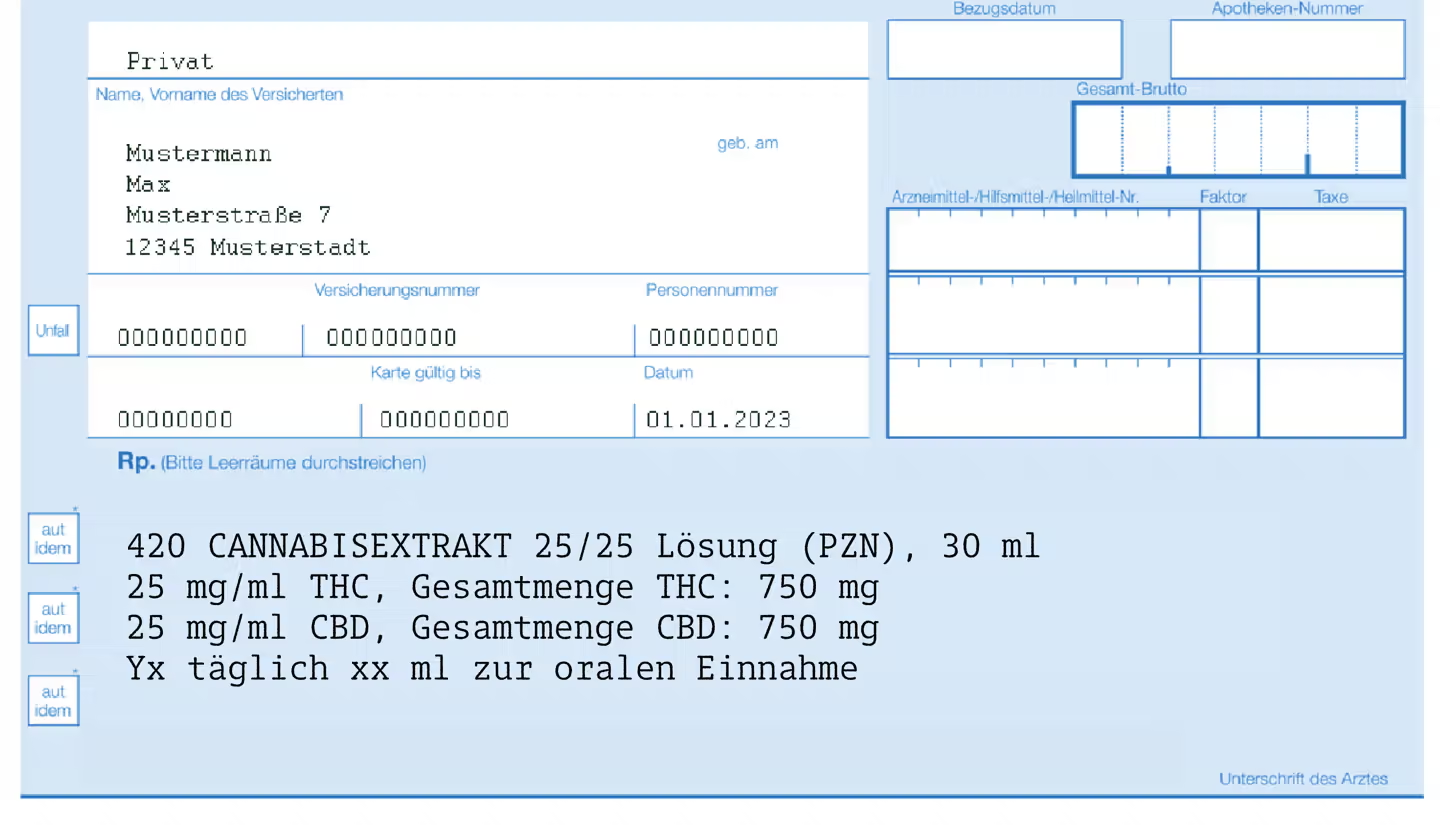
Zubereitung: Herstellung einer lipophilen Schmelze
- Vorbereitung der Kapseln
- Kapselhüllen mithilfe eines Kapselbretts öffnen.
- Mischung des Cannabisextrakts
- Cannabisextrakt in einem Becherglas mit der erforderlichen Menge Palmitoylascorbinsäure zu einer homogenen Masse verrühren, sodass keine Pulvernester oder Agglomerate vorhanden sind.
- MCT-Öl erhitzen
- MCT-Öl bei maximal 70 °C verflüssigen.
- Emulgieren
- Polyoxyethyliertes Rizinusöl zur Cannabisextrakt-Palmitoylascorbinsäure-Mischung hinzufügen und gründlich verrühren, bis eine homogene Lösung entsteht.
- Erstellen der lipophilen Schmelze
- Geschmolzenes Hartfett zugeben, um die lipophile Schmelze herzustellen. Falls nötig, die Extraktmischung ebenfalls leicht erwärmen, um eine Phasenbildung zu vermeiden.
- Befüllen der Kapseln
- Mit einer weitlumigen Kanüle und Einmalspritze die Kapselunterteile gleichmäßig bis zur Oberkante (plane oder leicht konkave Oberfläche) mit der Schmelze befüllen.
- Aushärten
- Die befüllten Kapseln etwa 30 Minuten aushärten lassen. Durch die Volumenkontraktion entstandenen Freiraum nicht nachfüllen, um eine mögliche Überdosierung zu vermeiden.
- Verschließen und Wiegen
- Kapseln verschließen
Rezeptur für verschiedene Kapselstärken
2.5mg THC/Kapsel
Substanz | 420 Cannabisextrakt THC 10 CBD 10 | 420 Cannabisextrakt THC 25 CBD 25 | 420 Cannabisextrakt THC 20 CBD 0 | |||
|---|---|---|---|---|---|---|
g | Anteil % | g | Anteil % | g | Anteil 5% | |
420 Cannabisextrakt | 0,2375 | 54,74 | 0,0950 | 21,89 | 0,1185 | 27,37 |
Polyoxyethyliertes Rizinusöl | 0,0310 | 7,14 | 0,0310 | 7,14 | 0,0310 | 7,14 |
Palmityolascorbinsäure | 0,0002 | 0,05 | 0,0002 | 0,05 | 0,0002 | 0,05 |
MCT | 0,2127 | 49,02 | 0,3077 | 70,92 | 0,2824 | 65,44 |
Gesamtgewicht | 0,4339 | 100 | 0,4339 | 100 | 0,4339 | 100 |
Anteil CBD | 2.5mg | 2.5mg | - |
5mg THC/Kapsel
Substanz | 420 Cannabisextrakt THC 25 CBD 25 | 420 Cannabisextrakt THC 20 CBD 0 | ||
|---|---|---|---|---|
g | Anteil % | g | Anteil % | |
420 Cannabisextrakt | 0,1900 | 43,79 | 0,2375 | 54.74 |
Polyoxyethyliertes Rizinusöl | 0,0310 | 7,14 | 0,310 | 7,14 |
Palmityolascorbinsäure | 0,0002 | 0,05 | 0,0002 | 0,05 |
MCT | 0,2127 | 49,02 | 0,2127 | 49,02 |
Gesamtgewicht | 0,4339 | 100 | 0,4339 | 100 |
Anteil CBD | 5mg | - |
10mg THC/Kapsel
Substanz | 420 Cannabisextrakt THC 25 CBD 25 | |
|---|---|---|
g | Anteil % | |
420 Cannabisextrakt | 0,38 | 87,58 |
Polyoxyethyliertes Rizinusöl | 0,0310 | 7,14 |
Palmityolascorbinsäure | 0,0002 | 0,05 |
MCT | 0,0227 | 5,23 |
Gesamtgewicht | 0,4339 | 100 |
Anteil CBD | 10mg |
Endprozesskontrolle
Die Kapseloberfläche muss frei von Schmelzresten sein.
Die Gleichförmigkeit der Masse wird gemäß Ph.Eur. 2.9.5 geprüft. Dazu werden entweder die einzelnen Kapseln gewogen oder das Gesamtgewicht von 20 Kapseln ermittelt und die Durchschnittsmasse berechnet. Bei maximal 2 der 20 Kapseln (≥ 300 mg Nettomasse) darf die Einzelmasse des Inhalts um mehr als 7,5 % von der Durchschnittsmasse abweichen, jedoch bei keiner Kapsel um mehr als 15 %. Zur Prüfung der Gleichförmigkeit und Masserichtigkeit kann die Rechenhilfe „Schmelzebefüllte Hartkapseln: Ansatzberechnung und Inprozessprüfungen“ (DAC/NRF-Tools) verwendet werden.
Abfüllung, Verpackung und Lagerung
Die Kapseln werden direkt nach der Zubereitung in geeignete Behältnisse abgefüllt. Folgende kindergesicherte Packmittel sind geeignet:
- Braunglasflasche mit Weithals (75 ml, 100 ml oder 125 ml)
- Vierkantflasche aus HDPE
- Kunststoffbehältnis mit Druck-Dreh-Verschluss
Kennzeichnung
Die hergestellte Rezeptur muss entsprechend den Vorgaben der Apothekenbetriebsordnung gekennzeichnet werden.
Freigabe
Die Freigabeprüfung erfolgt durch eine:n Apotheker:in und wird per Unterschrift im Herstellungsprotokoll dokumentiert. Die Kapseln dürfen keine Verformungen aufweisen. Bei Verwendung eines kindergesicherten Gefäßes ist dessen Funktionsfähigkeit zu prüfen.
Lagerung
Die Hartkapseln sind dicht verschlossen, lichtgeschützt, bei Raumtemperatur (< 25 °C) und außerhalb der Reichweite von Kindern aufzubewahren.
Aufbrauchfrist
In Anlehnung an die NRF-Rezeptur 22.7. kann eine Aufbrauchfrist von 6 Monaten angenommen werden.
